当社の経鼻投与基盤技術は、
独自の粉末製剤技術と
投与デバイス技術からなる
Combination Technologyです





3D Nasal Cast Model
管理用
当社が開発中のゾルミトリプタン経鼻剤(開発コード;TRZ)について、米国における臨床第I相試験の実施許可申請に必要な非臨床試験が完了し、臨床試験に向けてのステップが進みましたことをお知らせいたします。
偏頭痛は、頭の片側からこめかみにかけて脈打つように「ずきずき」、「がんがん」と痛み、ひどいときには日常生活が妨げられるほどの強さの痛みや、吐き気を伴うとてもつらい頭痛であり、患者さんは速やかにその痛みを緩和できて、しかも注射に替わるタイプの製剤を強く望んでいます。本製剤の有効成分であるゾルミトリプタンは、既に臨床で広く使われている偏頭痛治療薬ですが、当社では、患者さんが注射をすること無く、速やかにしかも簡便な投与方法で偏頭痛を緩和させる新しいタイプの製剤開発を目指して、独自の経鼻投与技術(μco™system;ミューコシステム)を応用したTRZ を完成させました。
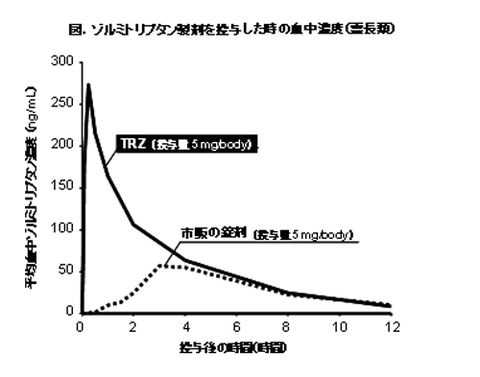
右図に示したとおり、本製剤(TRZ)は、霊長類(カニクイザル)を用いた前臨床試験において、その安全性と速やかで高い吸収性が確認されました。すなわち、市販のゾルミトリプタン錠経口剤に比べて、TRZは、投与直後から速やかに吸収が始まり、しかも高い吸収性が確認されました。このことから、患者さんの偏頭痛をより早く緩和させる新しい製剤となりえることが示唆されました。
今後、ヒトでの吸収性、忍容性及び安全性を確認する臨床第 I 相試験を実施すべく、既に申請済の米国FDA とのPre-IND 会議*1 を経た後、年内にはIND 申請*2 を完了させ、来年3 月までに当該臨床試験のデータを取りまとめる予定です。
米国では全人口の10%に相当する約2,800 万人が、日本では約840 万人がそれぞれ偏頭痛に苦しんでおり、世界市場は約3,500 億円にも上ります。患者さんは、働き盛りの20 歳-40 歳代の若い年齢層に多いことが特徴で、日常生活の中で、いつ強い頭痛が起きるか不安を持っており、偏頭痛を速やかに緩和させる製剤を強く望まれております。しかしながら、現状の市販製剤では、速やかな効果が安定して得られるものは注射剤しかなく、患者さんは注射以外の方法で簡便に投与でき、しかも速やかな効果が安定して得られる製剤を強く望んでおります。当社は、米国における複数の偏頭痛専門医に対してヒヤリングを行った結果、速効性が期待できて注射に替わる製剤で、さらに使い勝手や携帯性にも優れた本製剤TRZは、患者ニーズに適合した将来性のある製剤であると推奨されております。
なお、当社では、すでに制吐作用を有するグラニセトロンにμco™ system を応用したグラニセトロン経鼻剤について、米国での臨床第II相試験を完了させ、高い安全性と有効性(患者満足度96.6%)を確認しております。今回、同技術を応用したTRZ の非臨床試験の結果は、同技術の汎用性を裏付けるものと言え、他の有効成分についても、μco™system に応用することで、既存の市販製剤に優る速効性、吸収の改善や利便性の向上などといった新たな特徴を有する製剤新薬として開発が可能です。
このような効率の良い医薬品開発モデルに対する製薬企業各社の関心は非常に高く、既に当社では、複数の製薬企業が有する化合物について、μco™ system への応用性を評価するための試験の受託サービスを実施しております。
今後、本製剤は、速やかに臨床第I相試験を完了させた後、2011 年9月頃までに臨床第II相試験を開始し、2012 年3月頃までには完了させる予定です。なお、本件は、当社の今期業績に及ぼす影響は軽微であります。
以上
【備考】
*1 Pre-IND 会議;臨床試験実施のためのFDA との事前会議
*2 IND;臨床試験実施許可をFDA に申請すること